¿QUE ES TECNICA?

Es un procedimiento o conjunto de estos, (reglas, normas o protocolos), que tienen como objetivo obtener un resultado determinado, ya sea en el campo de la ciencia, de la tecnología, del arte, de la educación o en cualquier otra actividad.
Supone el razonamiento inductivo y analógico de que en situaciones similares una misma conducta o procedimiento produce el mismo efecto, cuando éste es satisfactorio. Es por tanto el ordenamiento de la conducta o determinadas formas de actuar y usar herramientas como medio para alcanzar un fin determinado.
TECNICAS DE PRECIPITACION Y AGLUTINACION
TECNICAS DE PRECIPITACION
Para la realización de estas técnicas se requiere que tanto el Ac como el Ag se encuentren en un medio fluido en el que sea posible la precipitación del complejo Ag-Ac. Existen diferentes modalidades siendo las principales:
1. Técnica de precipitación propiamente dicha.
2. Técnica de difusión radial de Ouchterlony.
3. Técnica de inmunoelectroforesis.
4. Técnica de difusión radial simple de Mancini.
Técnica de precipitación

El complejo Ag-Ac precipita espontáneamente o por centrifugación cuando la proporción de Ags y Acs de la mezcla es equivalente. tipos de complejos formados al mezclar, en tubos de ensayo, soluciones con diferentes cantidades de antígenos a los que se añaden igual cantidad de un antisuero. La precipitación es máxima allí donde la proporción entre ambos es óptima (parte central de la curva), pero va disminuyendo a medida que predomine el Ac o el Ag (izquierda y derecha de la curva respectivamente) Este tipo de reacción no es muy utilizado al requerirse grandes concentraciones de antígeno y de anticuerpo para poder medir el precipitado formado.
Técnica de difusión radial doble de Ouchterlony

Se realiza en placas de agar en donde se practican pocillos En uno de estos pozos se coloca el suero o muestras a investigar y en el resto se coloca el anticuerpo preparado frente a la sustancia que se quiere identificar. Cuando difunden, ambos se encontrarán y se formará en la zona de equivalencia el complejo Ag-Ac correspondiente que se hace visible en forma de línea de precipitación. En preparación que tenga varios antígenos, se obtendrán múltiples líneas de precipitado.
Esta técnica permite identificar sustancias según la forma de unirse las líneas de precipitación de dos o varios sistemas.
Técnica de inmunoelectroforesis

Se realiza en dos fases. Primero se separa la mezcla de Ags por electroforesis y posteriormente el antígeno que se desea detectar se hace reaccionar con un anticuerpo específico colocado en un pocillo lateral. Por difusión llegan a encontrarse los antígenos y el antisuero, apareciendo el complejo Ag-Ac visible en forma de líneas de precipitación que pueden ser estudiadas por comparación con un sistema estándar . En Inmunología clínica, esta técnica puede utilizarse en la identificación de las proteínas de mieloma.
Técnica de difusión radial simple de Mancini

Se basa en la difusión de un antígeno colocado en un pocillo en un gel de agarosa que lleva incorporado un anticuerpo específico. Este anillo de precipitación es visible y las concentraciones antigénicas están en relación directa con el área del círculo de precipitación. Al difundir el antígeno se genera un gradiente de concentración desde el pocillo donde se ha colocado. Cuando la concentración del antígeno es la adecuada el inmunocomplejo se insolubiliza y se forma un anillo de precipitación
Concepto de equivalencia.efecto prozona-zona-prostzona
Tecnicas de deteccion union antigeno- anticuerpo
1._ precipitación
Difucion masiva
Combinada con electroforesis
Precipitación en base fluida (nefelometria,turbidimetria)
TECNICAS DE AGLUTINACION
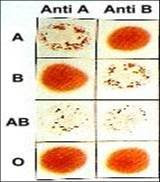
En estas técnicas se hacen visibles los complejos Ag-Ac por la aglutinación que producen los anticuerpos cuando el Ag forma parte o se ha unido a la superficie de glóbulos rojos, plaquetas, leucocitos, partículas de látex, etc. Normalmente se utilizan glóbulos rojos (hemaglutinación) o partículas de látex.
Hemaglutinación directa

La presencia de antígenos en la superficie de los glóbulos rojos se puede detectar por la hemaglutinación producida cuando se añade un antisuero con anticuerpos frente a dichos antígenos.
Se emplea para la identificación de los grupos sanguíneos y Rh, para lo cual a la sangre heparinizada se le añaden los antisueros correspondientes: anti- A, anti-B o anti-AB (todos ellos anti-Rh negativos). Habrá aglutinación cuando los glóbulos rojos posean la especificidad del antisuero añadido. De igual manera se procede con antisueros anti-Rh para la determinación de los distintos grupos Rh.
Hemaglutinación indirecta

Es el principio de la inhibición de la hemaglutinación. se precisan glóbulos rojos a los cuales se les ha unido la misma sustancia que se desea detectar Si estos glóbulos rojos son puestos en presencia de anticuerpos preparados frente a dicha sustancia se producirá su aglutinación. Por el contrario, cuando se añade un suero problema que contiene la sustancia a cuantificar los anticuerpos se unirán a dicha sustancia y no a los glóbulos rojos. En este caso no se producirá la hemaglutinación. aglutinación (+) indica ausencia de la sustancia a estudiar, y aglutinación (-) indica presencia de la misma
TECNICAS DE INMUNOFLUORESCENCIA

La fluorescencia es una propiedad de ciertas moléculas que, al ser irradiadas con energía electromagnética de longitud de onda adecuada, emiten radiación de longitud de onda característica permitiendo su cuantificación.
Las moléculas de un colorante fluorescente absorben luz en una longitud de onda y convierten la luz absorbida de alta energía en luz de menor energía. Cada fluorocromo tiene un espectro de emisión y excitación característicos; si se utilizan dos con el mismo espectro de excitación pero distinto espectro de emisión, se pueden medir dos características al mismo tiempo (fluorescencia de dos colores).
La inmunofluorescencia se utiliza en la detección de autoanticuerpos y anticuerpos contra antígenos de superficie de células y tejidos se emplean anticuerpos preparados frente a la proteína que se desea detectar con moléculas fluorescentes Se aprecia si hubo unión del anticuerpo con el antígeno por la fluorescencia emitida, bajo microscopio de luz ultravioleta. Este procedimiento (Inmunofluorescencia directa) tiene la limitación del marcaje con un fluorocromo
lo que se hace es tratar el tejido o células con antisueros anti-antígeno producidos,
CITOMETRIA DE FLUJO

La técnica de inmunofluorescencia se suele utilizar en el estudio de poblaciones de células de sangre periférica. el análisis de una suspensión de células vivas marcadas con un fluorocromo se realiza mediante un citómetro de flujo. La suspensión celular se hace circular en forma de gotas microscópicas. Las células pasan por un campo de detección atravesado por un potente rayo láser que produce la dispersión de la luz y la activación de la fluorescencia. Mediante sensores específicos se analizan y cuantifican en función de sus propiedades fisicoquímicas y del marcaje efectuado. Para la separación celular lleva acoplado un sistema que carga eléctricamente las células y con placas deflectoras tambien lo hace en otras propiedades diferenciales de las células tamaño (FSC), complejidad (SSC), etc. La señal permite conocer el porcentaje de células reconocido por el anticuerpo monoclonal empleado. La puesta a punto de las técnicas de citofluorometría, en las que se conjugan los avances de informática, rayos láser y anticuerpos monoclonales permite el análisis fenotípico y funcional de las células T, B y Marcadores de linfocitos B. Para cuantificar los linfocitos B totales se utiliza el marcador CD19., en los linfocitos B activados se pierde la expresión de las moléculas CD21, CD22 y CD24, hay un incremento en la expresión de moléculas HLA-DR y de receptores de linfocinas y aparecen marcadores nuevos, como el CD23, ausente en linfocitos B en reposo. Marcadores de linfocitos T. se utilizan los marcadores CD3, CD4 y CD8 presentes de forma específica en linfocitos T totales y en la subpoblaciones de células T de colaboración y citotóxicas/supresoras respectivamente. En el proceso de activación celular T se expresan nuevas moléculas de superficie, son receptores para factores de crecimiento y proliferación celular. antígenos de activación a) receptores de interleucinas (como la molécula CD25 que corresponde a la cadena p55 del receptor de la IL-2); b) receptores de la insulina y de la transferrina (CD71); c) antígenos del Complejo Mayor de Histocompatibilidad (CMH) clase II, que no están presentes en linfocitos T en reposo; y d) una gran variedad de moléculas de superficie, cuya función no es totalmente conocida (por ejemplo, CD26, CD29, VLA-2, CD69).
TECNICA DE RADIOINMUNOENSAYO

El radioinmunoensayo (RIA) la competencia que se establece, para unirse a anticuerpos específicos, entre la sustancia a cuantificar y cantidades conocidas de la misma sustancia marcada con un isótopo. Al establecerse esta competición resulta que a mayor cantidad de sustancia a cuantificar, menor será la cantidad de sustancia radiactiva que se une al anticuerpo y viceversa se obtienen al medir la radiactividad de la hormona marcada unida al anticuerpo y la de la hormona marcada libre mediante un contador de centelleo. Al centrifugar, la hormona libre queda en solución y la hormona unida al anticuerpo forma agregados fácilmente precipitables. se construye una curva con los resultados obtenidos con cantidades de hormona sin marcar y marcada. A esta curva se llevan los valores obtenidos de los sueros problema y se obtiene la concentración de la hormona no marcada a investigar.
En el RIA directo, a la fase sólida se une una cantidad conocida de Ac. Diferentes concentraciones conocidas de antígeno marcado se incuban con una concentración constante de la muestra de la que se desea conocer la concentración del antígeno en cuestión. Para el proceso de inhibición se incuba una concentración fija de anticuerpo marcado frente a una serie de diluciones de la muestra que contiene el antígeno. Existe una técnica no competitiva que es la denominada sandwich: Se une un Ac en cantidades constantes a la fase sólida. se añade el antígeno en concentraciones variables. El marcaje de proteínas o péptidos con yodo radiactivo I125 ó I132 puede realizarse por diferentes métodos. La incorporación del yodo a la molécula se realiza en los aminoácidos aromáticos que forman parte de la estructura de la cadena peptídica: tiroxina, fenilalanina, triptófano o histidina.
La técnica del radioinmunoensayo posee algunos inconvenientes que derivan de la necesidad de utilizar isótopos. Además de su peligrosidad y la obligatoriedad de disponer de instalaciones adecuadas para su utilización, existen isótopos que tienen el inconveniente de su pronta caducidad.
TECNICA DE ENZIMOINMUNOENSAYO.

Conoce como test de ELISA La identificación de los complejos Ag-Ac, se hace mediante el empleo de enzimas, bien unidas al antígeno, o bien unidas al anticuerpo. puede ser directo o no competitivo, constando de los siguientes pasos: ´
a) Se tapiza la placa con el anticuerpo específico frente al antígeno a determinar.
b) Se añade la muestra con el antígeno.
c) Se adiciona el anticuerpo secundario marcado con la enzima que en presencia de su sustrato da un producto coloreado soluble, este producto es cuantificado mediante el lector de ELISA e indirecto o competitivo, se diferencia en que se añaden los anticuerpos, previamente incubados con la muestra, los anticuerpos que no se han unido a los antígenos de la muestra lo harán a los antígenos de los pocillos Como enzimas se suelen utilizar la peroxidasa, la galactosidasa o la glucosa oxidasa.
Esta técnica se utiliza para la medida de hormonas, antígenos de la hepatitis y otras muchas sustancias que se encuentran a muy bajas concentraciones.
Una variante de esta técnica de gran utilidad se conoce como test en fase sólida y está orientada a la determinación de anticuerpos frente a un determinado antígeno. Para ello el antígeno se encuentra fijo a un soporte. Al añadir la muestra con el posible anticuerpo se unirá y podrá ser detectado añadiendo anti-inmunoglobulinas marcadas con el enzima. La diferencia principal entre las técnicas de RIA y ELISA es que la primera utiliza como marcador un isótopo y la segunda la actividad de un enzima,
TECNICAS NEFELOMETRICAS

se basan en la detección de los complejos Ag-Ac, por la refracción que dichos complejos producen sobre rayos de luz que se hacen pasar por el tubo con el antígeno y el anticuerpo correspondiente. se utilizan rayos láser y se establece una relación entre la cantidad de luz que llega y la cantidad de complejos formados Este es rápido y sensible y se está utilizando en la actualidad, para la cuantificación de proteínas en suero y en otros líquidos biológicos.
SELECCION DE CELULAS UNIDAS A UN ANTICUERPO

La adición de complemento elimina dicha población celular (selección negativa), es la denominada técnica de inmunotoxicidad.
La separación inmunomagnética se basa en la interacción entre antígenos celulares superficiales y anticuerpos unidos a bolas magnéticas La aplicación de un campo magnético permite separar las células unidas a las bolas (selección positiva) de las células no unidas (selección negativa). Es un método fácil, rápido y no muy costoso. presenta muchas aplicaciones no sólo en Inmunología, utilizando bolas unidas a anticuerpos frente a un determinado microorganismo; se pueden usar para la purificación de proteínas si se unen las bolas a anticuerpos específicos.
TECNICAS USADAS EN EL AISLAMIENTO DE ANTICUERPOS O ANTIGENOS PUROS.

Puede aplicarse en el aislamiento de una población pura de anticuerpos. se prepara un inmunoabsorbente en fase sólida, que es un antígeno unido covalentemente a un soporte inerte, por ejemplo bolitas de dextrano entrecruzadas. El inmunoabsorbente, se coloca en una columna y la mezcla de anticuerpos se hace pasar a través de él bajo condiciones fisiológicas. Los anticuerpos específicos para el antígeno permanecen unidos a la columna, y aquellos que no se unen son eliminados mediante lavado. se eluye la columna, usando un tampón de elución que disocia la unión antígeno-anticuerpo para obtener el anticuerpo que se unió al inmunoabsorbente. A la inversa, colocando anticuerpos en la columna se tendrá antígeno puro.
INMUNOPRECIPITACION E INMUNOBLOTTING

Cuando se asocia a electroforesis en gel de SDS-poliacrilamida. se pueden determinar la presencia y cantidad de un antígeno, el peso molecular relativo de una cadena polipeptídica, su síntesis y degradación, la interacción con proteínas, ácidos nucleicos u otros ligandos. se divide en cuatro pasos
1. Marcaje del antígeno (opcional)
2. Lisis de las células para liberar el Ag
3. Formación del complejo Ag-Ac
4. Purificación de los inmunocomplejos
El antígeno se marca incubándolo con un precursor radiactivo aunque muchos antígenos se pueden detectar por medios que no requieren marcaje directo. se extrae de las células mediante lisis. Después, los anticuerpos se añaden al lisado y se forman los inmunocomplejos Ag-Ac. Estos se unen por adsorción a una fase sólida que contiene proteína A. Los inmunocomplejos se analizan por electroforesis en gel pero pueden ser usados en diferentes técnicas Una de estas técnicas es el Western blot que combina la resolución de la electroforesis en gel con la especificidad de la detección inmunoquímica. Se utiliza para determinar la presencia y cantidad de antígenos y de anticuerpos específicos. En la actualidad es el test confirmatorio
más empleado para el diagnóstico del SIDA.
OTRAS TECNICAS BASADAS EN LA UNION ANTIGENO-ANTICUERPO

Las técnicas basadas en el marcaje de anticuerpos con ferritina u oro coloidad, de gran utilidad en microscopía electrónica.
La técnica de anticuerpos marcados con ferritina se basa en el hecho de que casi el 25% de esta molécula está formada por hierro que, al ser opaco a los electrones, puede ser detectado en microscopía electrónica. Los anticuerpos pueden ser combinados a la ferritina (u otras proteínas) mediante ligandos bivalentes como el 1,3-difluoro-4,6-dinitrobenceno o la bencidina bidiazoica entre otros.
La técnica basada en el marcaje de anticuerpos con oro coloidal y su uso en microscopía electrónica se basa, al igual que en el caso anterior, en la opacidad de estas moléculas a los electrones. Estas técnicas son de gran utilidad en inmunohistología e inmunocitología humana, animal y vegetal. También están tomando cada vez mayor auge las técnicas quimioluminiscentes. La quimioluminiscencia consiste en la producción química de la luz. Los marcadores quimioluminiscentes son sustancias capaces de emitir luz cuando, al absorber la energía de una reacción química oxidativa, son colocadas en un estado de excitación electrónica. La emisión de luz se produce al volver a su estado inicial y la energía química absorbida se cede en forma de fotones fácilmente cuantificables con un fotodetector. Los marcadores quimioluminiscentes constituyen una alternativa al uso de isótopos radiactivos en el inmunoanálisis, pues los compuestos quimioluminiscentes son de gran estabilidad y la emisión de luz sólo se produce cuando se provoca la reacción oxidativa siendo posible almacenar largo tiempo los compuestos luminiscentes.
LA TÉCNICA ELISA

La técnica de Elisa es un procedimiento de ensayo inmunoenzimático cuyo nombre resulta de la asociación de las iniciales de su denominación inglesa (enzyme linked inmuno sorbent assay). Como todo ensayo inmunoenzimático, la prueba recurre al empleo de inmunógenos, haptenos ó anticuerpos marcados con una enzima, para revelar el reactivo complementario a nivel de distintos fluidos biológicos.
El área de sus aplicaciones médicas se ha expandido en forma sostenida, siendo utilizada como el primer sustituto de la técnica de Radioinmunoensayo* en la medición de hormonas, inmunoglobulinas, antígenos y anticuerpos en infecciones bacterianas, micósicas, parasitarias o virósicas.
De un modo general se procede a la fijación de uno de los componentes de la reacción inmunológica (antígeno Ag o anticuerpo Ac) a un soporte sólido, poniendo luego ese sistema en contacto con una fase fluida que contiene el reactivo complementario. El complejo inmunológico formado es enfrentado luego a las moléculas capaces de reconocer a su componente más superficial, marcadas con una enzima (peroxidasa de rábano picante); agregándose posteriormente un sustrato cromogénico de la enzima marcadora. La existencia de una reacción inmunológica se demuestra y se cuantifica midiendo espectrofotométricamente la cantidad de producto enzimático resultante.
TECNICAS DE BIOLOGIA MOLECULAR UTILES EN INMUNoLOGIA.

utilizadas en inmunología. es la Southern Blot. consiste en la separación de fragmentos de DNA previamente obtenidos por digestión con enzimas de restricción. La separación se hace mediante electroforesis y después este DNA es transferido a membranas de nylon o nitrocelulosa (blot). Después, para la identificación de la banda que interesa se realiza un proceso llamado hibrización, en el que la membrana es "incubada" con un fragmento de DNA complementario al gen de interés (sonda) previamente marcada, generalmente con un isótopo, lo que permite posteriormente visualizar mediante autoradiografía la banda en la cual se ha producido unión
Hemaglutinacion
Test de coombs directo e indirecto
Uso del latex


